WASHINGTON (Reuters) – Badan Pengawas Obat dan Makanan AS mengatakan pada Rabu (16 Desember) bahwa dosis tambahan dari vial vaksin Covid-19 Pfizer dapat digunakan setelah laporan dosis vaksin dibuang oleh apoteker karena kebingungan pelabelan.
Stat News melaporkan sebelumnya bahwa apoteker rumah sakit mendapati diri mereka dalam posisi membuang satu dari setiap enam dosis vaksin Covid-19 Pfizer-BioNTech pertama yang didistribusikan minggu ini di Amerika Serikat karena kebingungan tentang pelabelan.
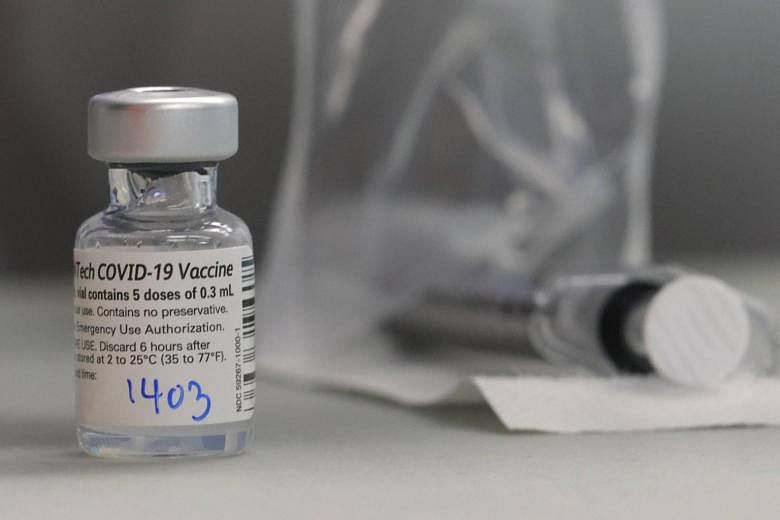
Botol Pfizer seharusnya menampung lima dosis, menurut label, tetapi laporan media mengatakan apoteker telah menemukan cara untuk dosis keenam atau bahkan ketujuh. Tanpa persetujuan yang jelas dari produsen, dosis tambahan harus dibuang.
“Pada saat ini, mengingat keadaan darurat kesehatan masyarakat, FDA menyarankan bahwa dapat diterima untuk menggunakan setiap dosis penuh yang dapat diperoleh (keenam, atau bahkan mungkin ketujuh) dari setiap botol, menunggu penyelesaian masalah ini,” kata perwakilan FDA dalam sebuah pernyataan email.
“Namun, karena botol bebas pengawet, penting untuk dicatat bahwa setiap produk yang tersisa lebih lanjut yang bukan merupakan dosis penuh tidak boleh dikumpulkan dari beberapa botol untuk membuatnya,” tambah pernyataan itu.
Peluncuran tahap pertama 2,9 juta dosis vaksin yang baru disahkan dari Pfizer dan mitra Jerman BioNTech SE berlanjut untuk hari penuh ketiga, dengan pengiriman menuju ke 66 pusat distribusi lagi di seluruh Amerika Serikat.
Vaksin kedua dari Moderna dapat memenangkan persetujuan penggunaan darurat dari FDA minggu ini.
Tambahan 2 juta dosis vaksin Pfizer dan 5,9 juta dosis vaksin Moderna dapat dialokasikan minggu depan, Menteri Kesehatan dan Layanan Kemanusiaan AS Alex Azar mengatakan pada panggilan konferensi pada hari Rabu. Dua dosis vaksin, diberikan tiga atau empat minggu terpisah, akan diperlukan untuk setiap orang yang diinokulasi.